- Language
- 🇬🇧
- Joined
- Jul 6, 2021
- Messages
- 328
- Reaction score
- 343
- Points
- 63
Psylocybina (fosforan 3-[2-(dimetyloamino)etylo]-1H-indolo-4-ylo dihydrogenu) jest alkaloidem z rodziny tryptamin, fosforylowaną pochodną psylocyny, która ma właściwości psychodeliczne. Spośród wszystkich biologicznych źródeł psylocybiny, gatunki grzybów z rodzajów Psilocybe, Panaeolus, Stropharia, Gymnopilus, Inocybe zawierają największą jej ilość; jednak około 200 innych gatunków grzybów zawiera psylocybinę. Rodzina grzybów zawierających psylocybinę, która jest dobrze znana pod nazwą "magicznych grzybów", była używana ze względu na jej halucynogenne działanie w całej historii. Pod koniec lat pięćdziesiątych Albert Hoffman z firmy Sandoz Laboratories wyizolował i zsyntetyzował psychoaktywne związki psylocybiny i psylocyny z grzybów zawierających psylocybinę. Psilocybina była sprzedawana przez Sandoz jako indocybina do podstawowych psychofarmakologicznych i terapeutycznych badań klinicznych. Obecnie gatunki Psilocybe znane są w Azji, Australii, Stanach Zjednoczonych, Kanadzie, Meksyku, Ameryce Środkowej i Południowej, Afryce i Europie. Istnieje wiele dowodów na to, że gatunki zawierające psilocybinę zaczęły występować w Afryce i Europie, a także wskazanie, że Psilocybe był obecny w Starym Świecie przed pojawieniem się współczesnych ludzi. Grzyby zawierające psilocybinę można znaleźć na wolności lub wyhodować w kontrolowanym środowisku z odcisków zarodników. Popularność psilocybiny gwałtownie wzrosła w latach 1960-tych. W 1970 roku została wymieniona w wykazie I, co doprowadziło do znacznego ograniczenia badań nad psilocybiną. Jednak ostatnie wstępne badania nad psilocybiną wykazały perspektywy jej zastosowania w leczeniu zaburzeń obsesyjno-kompulsywnych, uzależnienia od alkoholu, dużych zaburzeń depresyjnych i depresji u pacjentów z nieuleczalnym rakiem. Psilocybina jest sklasyfikowana jako substancja z Wykazu I w Stanach Zjednoczonych na mocy Ustawy o substancjach kontrolowanych z 1971 r.; w związku z tym każdego roku można produkować tylko ograniczone ilości. Pomimo statusu substancji z Wykazu I, psilocybina była popularnym narkotykiem rekreacyjnym od lat 60-tych XX wieku i choć jej użycie zmalało, odkąd stała się substancją kontrolowaną, jej rekreacyjne użycie trwa nadal. Większość innych krajów rozwiniętych sklasyfikowała psilocybinę i grzyby zawierające psilocybinę jako nielegalne. Głównym wyjątkiem od tej ogólnej zasady jest Holandia, która posiada lukę prawną pozwalającą na uprawę, sprzedaż i spożywanie psychoaktywnych "trufli" zawierających psilocybinę. Wczesne dowody używania psilocybiny przez szamanów z Ameryki Środkowej i Południowej zostały zidentyfikowane w wielu miejscach. Współczesne badania rozpoczęły się pod koniec lat 50-tych XX wieku od etnomykologa R. Gordona Wassona i były kontynuowane przez słynnych badaczy psychodelików Timothy'ego Leary'ego, Ralpha Metznera i Rama Dassa z Uniwersytetu Harvarda, Alberta Hofmanna z Sandoz Labs, Terrence'a McKennę i Jonathana Otta w latach 60-tych i na początku lat 70-tych XX wieku. Zainteresowanie psychiatrów i psychologów w latach 50. wynikało z postrzeganego potencjału psychodelików jako narzędzia skracającego psychoterapię. Badania nad psychodelicznym leczeniem uzależnień rozpoczęły się już w latach 50-tych. Często obserwowano wnikliwe efekty i pomagano w trzeźwości, co skłoniło Humphry'ego Osmonda do wymyślenia terminu "psychodeliczny" jako sposobu na opisanie zdolności "manifestowania umysłu" tej klasy narkotyków ". Większość badań klinicznych przeprowadzono w latach 60-tych, często przy użyciu syntetycznej wersji indocybiny.
Synteza Pcilocybiny
Syntezapsylocybiny
Psylocybina została znaleziona w ponad 100 gatunkach grzybów, z których wiele należy do rodzaju Psilocybe. Alkaloid psilocybina w rodzinie Inocybeacede pojawia się między 10 a 20 mya i jest prawdopodobne, że pojawienie się psilocybiny w rodzinie Psilocybe również pojawiło się mniej więcej w tym czasie. Obecnie gatunki Psilocybe znane są w Azji, Australii, Stanach Zjednoczonych, Kanadzie, Meksyku, Ameryce Środkowej i Południowej, Afryce i Europie. Istnieje wiele dowodów na to, że gatunki zawierające psylocybinę zaczęły występować w Afryce i Europie, a także wskazują na to, że Psiloche był obecny w Starym Świecie przed pojawieniem się współczesnych ludzi. Grzyby zawierające psilocybinę można znaleźć na wolności lub wyhodować w kontrolowanym środowisku z odcisków zarodników, które są tworzone poprzez umieszczenie kapelusza znanego grzyba na arkuszu papieru woskowanego i pozwolenie zarodnikom spaść na papier, tworząc unikalny odcisk palca grzyba. Chociaż ta druga metoda jest znacznie bardziej powszechna i bezpieczniejsza, niektórzy użytkownicy nadal szukają "magicznych grzybów" na wolności. Niebezpieczeństwo błędnej identyfikacji jest zawsze obecne i jest błędem, na który podatni są nawet najbardziej doświadczeni mikolodzy. Błędna identyfikacja może prowadzić do błędu, na który podatni są nawet najbardziej doświadczeni mikolodzy. Błędna identyfikacja może prowadzić od łagodnego dyskomfortu do śmierci. Nagła śmierć jest najczęściej obserwowana u mykologów amatorów poszukujących grzybów zawierających psylocybinę i innego rodzaju psychoaktywnego grzyba powszechnie znanego jako "muchomor" (Amanita muscaria), który jest kultowym czerwono-białym nakrapianym kapeluszem grzyba często widywanym w bajkach (zamiast psylocybiny, A. muscaria zawiera psychoaktywne leki muscimol i kwas ibotenio). Niestety, kilka gatunków Amanita jest śmiertelnie niebezpiecznych, w tym trafnie nazwane "Death Cap" (Amanita phalloides) i "Destroying Angel" (Amanita virosa), które mogą wyglądać bardzo podobnie do Amanita muscaria i gatunków pokrewnych. Dziedzictwo i wykorzystanie "magicznych grzybów" jest widoczne we wczesnej historii i trwa do czasów współczesnych. Wczesne dowody stosowania przez szamanów z Ameryki Środkowej i Południowej zostały zidentyfikowane w wielu miejscach. Współczesne badania rozpoczęły się pod koniec lat 50. XX wieku od etnomykologa R. Gordona Wassona i były kontynuowane przez słynnych badaczy psychodelików Timothy'ego Leary'ego, Ralpha Metznera i Rama Dassa z Uniwersytetu Harvarda, Alberta Hofmanna z Sandoz Labs, Terrence'a McKennę i Jonathana Otta w latach 60. i na początku lat 70. XX wieku. Zainteresowanie psychiatrów i psychologów w latach 50. wynikało z postrzeganego potencjału psychodelików jako narzędzia skracającego psychoterapię. Badania nad psychodelicznym leczeniem uzależnień rozpoczęły się już w latach 50-tych. Często obserwowano wnikliwe efekty i pomagano w trzeźwości, co skłoniło Humphry'ego Osmonda do wymyślenia terminu "psychodeliczny" jako sposobu na opisanie zdolności "manifestowania umysłu" tej klasy narkotyków.
Struktura psylocybiny i innych halucynogenów indoloalkiloaminowych jest podobna do endogennego neuroprzekaźnika serotoniny, hormonu melatoniny i rzekomo endogennej psychodelicznej N, N-dimetylotryptaminy. Wszystkie one wywodzą się z tego samego związku - tryptaminy. Psilocybina (O-fosforylo-4-hydroksy-N, N-dimetylotryptamina) i jej aktywny defosforylowany metabolit psylocyna (N, N-dimetylotryptamina) strukturalnie należą do grupy halucynogenów tryptaminowych/indolaminowych i są strukturalnie związane z serotoniną. Równoważna dawka do 1 mola psylocyny wynosi 1,4 mola psylocybiny. Substytucja jądra indolowego w pozycji 4 prawdopodobnie odgrywa istotną rolę w jej działaniu halucynogennym. Psylocybina i psylocyna w czystej postaci są białymi krystalicznymi proszkami. Podczas gdy psylocybina jest rozpuszczalna w wodzie, psylocyna z drugiej strony jest bardziej rozpuszczalna w lipidach. Jednak psylocynę można również rozcieńczać w zakwaszonym roztworze wodnym i w dimetylosulfotlenku (DMSO; do 100 mM). Ponadto obie substancje są rozpuszczalne w metanolu i etanolu, ale prawie nierozpuszczalne w eterze naftowym i chloroformie. Oba narkotyki są niestabilne w świetle (w szczególności w postaci roztworów), ich stabilność w niskich temperaturach w ciemności w atmosferze obojętnej jest bardzo dobra. Psilocybina jest związkiem termolabilnym, rozpuszczalnym w wodzie, metanolu, etanolu, ale nierozpuszczalnym w rozpuszczalnikach organicznych. Sama w sobie ma niezwykle niską aktywność; działa głównie jako prolek psylocyny. Wartości pKa wahają się od 1,3 do 6,5. Po wystawieniu na działanie światła ultrafioletowego jego stabilność w roztworze zostaje zakłócona, co powoduje utlenianie. Rozpuszczalny w 120 częściach wrzącego metanolu; trudno rozpuszczalny w etanolu; praktycznie nierozpuszczalny w chloroformie, benzenie, prężność par - 1,9X10-12 mm Hg w 25 ° C. Masa cząsteczkowa wynosi 285,25; ma amoniakalny smak, temperaturę topnienia 224 stopni Celsjusza, pH 5,2 w 50% etanolu wodnym, TDLo 75 mkg/kg po podaniu domięśniowym u ludzi, TDLo 60 mkg/kg po podaniu doustnym u ludzi, LD50 280 mg/kg po podaniu dożylnym u szczurów. Uważa się, że psylocybina słabo przenika przez barierę krew-mózg w porównaniu z psylocyną. Wynika to z różnicy w wiązaniach wodorowych, które sprawiają, że ta ostatnia jest bardziej lipofilowa, ułatwiając przejście przez barierę krew-mózg. Podczas oględzin, oczyszczona psylocybina i psylocyna są rozróżnialne. Jedna ma wygląd białego lub prawie białego kryształu igły, druga tworzy oleisty ciemnobrązowy do czarnego kolor.
Status prawny.
Rząd wprowadził zakaz posiadania psylocybiny i psylocyny w 1968 roku. W 1970 roku psylocybina i psylocyna zostały wymienione jako narkotyki z Wykazu I. W Stanach Zjednoczonych Denver, Oakland, Chicago, Ann Arbor i Santa Cruz zdekryminalizowały posiadanie magicznych grzybów, ale ich sprzedaż jest nadal zabroniona. W 2020 roku Oregon zalegalizował psilocybinę, a Dystrykt Kolumbii zdekryminalizował używanie magicznych grzybów. Sprzedaż i transport psilocybiny z Austrii jest nielegalny. Posiadanie zostało zdekryminalizowane, a uprawa jest legalna, o ile grzyby nie są przeznaczone do spożycia. Osoby przyłapane na posiadaniu grzybów przeznaczonych do użytku osobistego mogą być zobowiązane do poddania się bezpłatnej terapii. W Portugalii grzyby psilocybinowe są nielegalne, ale zdekryminalizowane. Osoby przyłapane na posiadaniu ilości przeznaczonych do użytku osobistego mogą być zobowiązane do poddania się rehabilitacji lub terapii. W Holandii grzyby psilocybinowe są legalne w postaci trufli. Zgodnie z polityką ONZ, psilocybina jest nielegalna we Włoszech; jednakże grzyby psilocybe są zdekryminalizowane. Zestawy do uprawy i zarodniki są legalne w sprzedaży i pozyskiwaniu, ale kary administracyjne, takie jak utrata prawa jazdy, mogą być konsekwencją przyłapania na posiadaniu grzybów. Hiszpania zdekryminalizowała osobiste posiadanie i konsumpcję grzybów psilocybinowych, podczas gdy sama psilocybina pozostaje nielegalna. Uprawa i sprzedaż jest nielegalna, a legalność zarodników i zestawów do uprawy jest niejasna. Brytyjskie Wyspy Dziewicze zezwalają na posiadanie i uprawę grzybów psilocybinowych. Chociaż ich sprzedaż lub transport jest nielegalny (ale nie jest egzekwowany). Posiadanie, sprzedaż, transport i uprawa grzybów psilocybinowych są legalne na Jamajce. Jamajka otwarcie sprzedaje grzyby psilocybinowe. Posiadanie, sprzedaż, transport i uprawa magicznych grzybów w Brazylii są legalne. Psilocybina i psylocyna są wymienione jako nielegalne, jednak same grzyby nie są uważane za nielegalne. Posiadanie magicznych grzybów jest nielegalne w Meksyku, chociaż nie ma egzekwowania, jeśli magiczne grzyby są w rdzennych kulturach. Uprawa grzybów jest nielegalna, chyba że grzyby są uprawiane na wolności. Sprzedaż i transport są nielegalne. Magiczne grzyby są legalne na Samoa. Od 2018 roku są nielegalne w Wietnamie.
Obecnie sklasyfikowane jako substancja z Wykazu I, naukowcy z Johns Hopkins University twierdzą, że grzyby psilocybinowe powinny zostać zdegradowane z Wykazu I do Wykazu IV. W 2019 r. miasto Oakland w Kalifornii zagłosowało za dekryminalizacją magicznych grzybów zaledwie miesiąc po tym, jak zdecydowało się na to Denver w CO. W Kalifornii dąży się do dekryminalizacji grzybów psilocybinowych na poziomie ogólnostanowym, a wiele grup zajmujących się świadomością psychodeliczną i rzecznictwem popiera tę zmianę. Co więcej, stanowa legislatura Oregonu rozważa przyjęcie ustawy dekryminalizującej grzyby psilocybinowe i oferującej licencje na uprawę. Wiele z tych obiecujących badań odbywa się dzięki Multidyscyplinarnemu Stowarzyszeniu Badań Psychodelicznych (MAPS), które obecnie prowadzi badania medyczne nad MDMA, psilocybiną, LSD, marihuaną, ibogainą i ayahuascą. Inna organizacja, Heffter Research Institute specjalizuje się w badaniach nad psilocybiną. Wśród członków zarządu Heffter Research Institute jest współzałożyciel dr David Nichols, powszechnie znany badacz, profesor i ekspert w dziedzinie chemii halucynogenów. Inni badacze to dr Dennis McKenna, ceniony pisarz, etnofarmakolog, psychonauta i brat zmarłego Terrence'a McKenny oraz dr Roland Griffiths, który prowadzi fenomenalne badania w Johns Hopkins nad psilocybiną i uzależnieniem. Obecnie prowadzonych jest również kilka międzynarodowych badań nad psilocybiną. Beckley Foundation, z siedzibą w Wielkiej Brytanii, sponsoruje jedne z najbardziej postępowych badań nad psilocybiną. Założona w 1996 roku przez Amandę Fielding - cenioną psychonautkę i naukowca - Fundacja Beckley sponsoruje obecnie badania nad neurobiologią psilocybiny, wraz z MAPS i Heffter. Badania te odbywają się w Imperial College London z udziałem dr Davida Nutta i dr Robin Carhart-Harris, z których oboje opublikowali w przeszłości badania nad psilocybiną, a mianowicie "Entropic Brain Model". Heffter sponsoruje również badanie w Szwajcarii zatytułowane "Wpływ psilocybiny na uwagę, percepcję i poznanie". Podobnie, MAPS sponsoruje badanie zatytułowane "Badania eksperymentalne nad wpływem psilocybiny na inwersję głębi lornetki i rywalizację lornetkową" w Niemczech.
Farmakokinetyka i farmakodynamika.
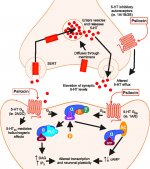
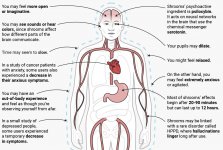
Po spożyciu, psylocybina ulega biotransformacji w wątrobie, gdzie jest defosforylowana do psylocyny przez nieznany enzym. Po przedostaniu się psylocyny do ogólnoustrojowego przepływu krwi, dostaje się ona do mózgu, gdzie wykazuje działanie psychoaktywne. Według innych danych, po podaniu doustnym, psylocybina jest szybko defosforylowana w kwaśnym środowisku żołądka lub pod działaniem fosfatazy alkalicznej (i innych niespecyficznych esteraz) w jelicie, nerkach i prawdopodobnie we krwi z utworzeniem fenolowego związku psylocyny, który może łatwo przechodzić przez barierę krew-mózg. Warto zauważyć, że względna siła działania psylocyny do psylocybiny jest niemal identyczna ze stosunkiem masy cząsteczkowej tych związków. Blokowanie fosfotazy alkalicznej przez konkurencyjne substraty β-glicerofosforanowe niweluje objawy zatrucia. Psylocyna przechodzi obie fazy metabolizmu. Metabolizm pierwszej fazy obejmuje oksydacyjną deaminację psylocyny do 4-hydroksyindolo-3-acetaldehydu katalizowaną przez monoaminooksydazę wątrobową lub dehydrogenazę aldehydową z następczym utlenianiem do kwasu 4-hydroksy-indolo-3-octowego, 4-hydroksy-indolo-3-acetaldehydu i 4-hydroksytryptofolu. Enzymy biorące udział w tym procesie nie zostały zidentyfikowane. Dlatego inhibitory MAO mogą wzmacniać halucynogenne efekty psilocybiny, podobnie jak etanol może wzmacniać trip, ponieważ jego główny metabolit aldehyd octowy reaguje in vivo z endogennymi aminami, w wyniku czego powstają inhibitory MAO - tetrahydroizochinoliny i β-karboliny. Ponieważ psilocybina indukuje konkurencyjne hamowanie MAO (który metabolizuje serotoninę), poziom serotoniny w mózgu wzrasta, a jednocześnie stężenie 5-HIAA jest zmniejszone. Istnieje również nieistotny pod względem efektów klinicznych szlak metaboliczny, który obejmuje utlenianie skutkujące powstawaniem ciemnoniebieskiego produktu o strukturze o-chinonu lub imino-chinonu. Szlak ten jest katalizowany przez oksydazy hydroksyindolowe (ceruloplazmina, oksydaza osocza ssaków zawierająca miedź i oksydaza cytochromowa). Powyższe metabolity wykazują nieznaczną aktywność fizjologiczną. Gdy psilocybina jest podawana pozajelitowo, fosfatazy tkankowe pełnią tę samą rolę, a te w nerkach są jednymi z najbardziej aktywnych. Biorąc pod uwagę, że konkurencyjna blokada defosforylacji blokuje psychotropowe działanie psilocybiny, jasne jest, że psylocyna jest głównym aktywnym metabolitem psilocybiny. W ciągu 5 godzin od doustnego podania psylocybiny, do 80% psylocyny jest obecne we krwi w postaci sprzężonego O-glukuronidu i jest wydalane z moczem w postaci niezmienionej. Glukuronidacja grupy hydroksylowej do O-glukuronidu psylocyny jest ważnym etapem detoksykacji, dlatego hydroliza enzymatyczna wydłuża czas wykrywania w próbkach moczu. Podczas gdy psylocyna ulega rozległej glukoronidacji przez UDP-glukuronozylotransferazy (UGT)1A10 w jelicie cienkim, UGT1A9 wnosi główny wkład w glukoronidację po jej wchłonięciu do krwi. N-glukuronidacja nie występuje w tym przypadku w całym metabolizmie. Oprócz wspomnianego powyżej szlaku, sama psylocyna ulega również metabolizmowi oksydacyjnemu. Demetylacja i desaminacja 4-hydroksyindolo-3-ylo-acetaldehydu (4-HIA) z późniejszym utlenianiem (przypuszczalnie przez wątrobową dehydrogenazę aldehydową i oksydazę monoaminową) prowadzi do powstania kwasu 4-hydroksyindolo-3-octowego (4-HIAA) i 4-hydroksytryptofolu (4-HT). Te nieznaczne metabolity (około 4% rozpada się w sposób opisany powyżej) można wykryć w ludzkim osoczu krwi. Trzeci sposób metabolizmu psylocyny obejmuje utlenianie przez oksydazy hydroksyindolowe, jak wspomniano powyżej. Psylocyna jest rozprowadzana do wszystkich tkanek, w tym mózgu, i jest eliminowana w ciągu 24 godzin. Większość jest eliminowana w ciągu pierwszych 8 godzin (około 65% z moczem i 15-20% z żółcią i kałem). Można ją wykryć w moczu w ciągu 2 tygodni. Najwyższe stężenia psylocyny znajdują się w korze nowej, hipokampie, pozapiramidowym układzie ruchowym i tworze siatkowatym. U ludzi psylocybina i psylocyna mogą być wykryte w osoczu krwi po 20-40 minutach od podania doustnego. Maksymalne stężenia są osiągane w ciągu 80-100 minut i mogą być wykryte w ciągu sześciu godzin. Okres półtrwania psylocyny w osoczu krwi wynosi około 2/5 godziny po podaniu doustnym i 1,23 godziny - po podaniu pozajelitowym. Jak już wspomniano, około 80% psylocyny w osoczu występuje w postaci sprzężonej. Psylocynę (90-97%) i psylocybinę (3-10%) można wykryć w moczu w postaci niezmienionej lub sprzężonej z kwasem glukoronowym. Okres półtrwania w fazie eliminacji wynosi około 50 minut, stała eliminacji wynosi 0,307/h. Większość substancji jest eliminowana w ciągu pierwszych trzech godzin po podaniu doustnym i jest całkowicie wydalana z moczem w ciągu 24 godzin. Kompletny szlak metaboliczny psilocybiny został zbadany w bardzo niewielkim stopniu i nadal istnieje wiele informacji, które należy zebrać, aby określić dokładne mechanizmy związane z jej metabolizmem.
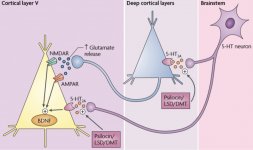
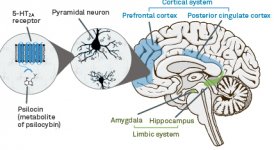
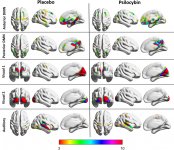
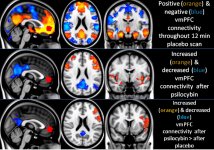
Farmakologia psilocybiny jest bardzo złożona i nie została dostatecznie zbadana. Przypuszczalnie psilocybina może mieć swoją własną, nieznaczną aktywność; jednakże, działa ona głównie jako prolek psylocyny. Ta ostatnia łatwo przenika przez barierę krew-mózg i ma tam swoje psychoaktywne działanie. Główne miejsca wiązania zostały podsumowane w powyższej tabeli. Psylocyna najsilniej wiąże się z receptorami serotoninowymi: 5-HT1D,2B,2C,5,6,7), ma również umiarkowany potencjał wiązania z miejscami receptorów serotoninowych(5-HT1A, 1B, 2A). Oprócz receptorów serotoninowych, psylocyna ma pewne powinowactwo do receptorów histaminowych pierwszego typu (H1), receptorów alfa-2A i -2B oraz receptorów dopaminowych trzeciego typu (D3). W neuronach wyrażających receptor 5HT2A, ale nie w nokautach 5HT2A, psilocybina zwiększa ekspresję wczesnych genów (erg-1, erg-2, c-fos, jun-B, period-1, gpcr-26, fra-1, N-10, I-κBα) i zmniejsza ekspresję sty-kinazy. Nie trzeba dodawać, że dokładny szlak sygnałowy prowadzący od receptora do aktywacji wczesnych genów nie jest jeszcze znany. Biorąc pod uwagę, że niehalucynogenny lizuryd również aktywuje c-fos, prawdopodobne jest, że ekspresja c-fos odzwierciedla jedynie zwiększoną aktywność neuronalną, podczas gdy ekspresja egr-1/egr-2 jest specyficzna dla efektu halucynogennego. Gonzales-Meaeso wyjaśnił tę selektywność "agonistycznym handlem teorią sygnalizacji receptora", gdzie halucynogeny aktywują heterokompleks receptora 5HT2A/mGlu2 i różne białka G w porównaniu do niehalucynogennych agonistów 5-HT2A. Hipoteza ta jest poparta badaniem, w którym myszy z znokautowanym genem dla receptora mGlu2 nie wykazują żadnych drgań głowy. Udowodniono, że psilokilina hamuje zależny od sodu transporter serotoniny (SERT), co prowadzi do wzrostu stężenia serotoniny. Serotonina pozostaje w szczelinie synaptycznej po jej uwolnieniu, co ostatecznie prowadzi do wielokrotnej aktywacji serotoninergicznych neuronów pozazwojowych. Jeśli chodzi o ocenę powinowactwa wiązania do receptorów, są one uporządkowane w następujący sposób: 5HT2B > 5HT1D > D1 > 5HT1E > 5HT1A > 5HT5A > 5HT7 > 5HT6 > D3 > 5HT2C > 5HT1B > 5HT2A. Udowodniono również wiązanie z receptorami imidazolinowymi pierwszego typu. Warto zauważyć, że powinowactwo psilocybiny do ludzkich receptorów 5-НТ2А jest 15 razy wyższe niż u szczurów. Agonizm receptorów 5НТ2А i aktywacja nadmiernej liczby tych receptorów i podtypów receptorów są odpowiedzialne za unikalne i intensywne efekty psychodeliczne wywoływane przez psilocybinę. Wcześniej toczyło się wiele dyskusji na temat tego, czy receptory 5-НТ2А lub 5-НТ2С są odpowiedzialne za izolowane halucynacje po spożyciu grzybów zawierających psylocybinę. Badania wykazały, że antagoniści 5-НТ2А tłumią halucynacje, podczas gdy antagoniści 5-НТ2С nie nasilają halucynacji, ani nie niwelują ich efektu. Tak więc agonizm receptorów 5-НТ2А wiąże się z ogólnym pobudzeniem neuronów, poprawą pamięci i uczenia się, skurczami mięśni gładkich naczyń krwionośnych, przewodu pokarmowego i oskrzeli, pewną aktywnością przeciwzapalną, zwiększoną produkcją prolaktyny i oksytocyny, hormonu adrenokortykotropowego i reniny po aktywacji układu renina-angiotensyna-aldosteron. Jeśli chodzi o aktywację 5-НТ2С przez psylocynę, następuje aktywacja proopiomelanokortyny (prekursora hormonu stymulującego α-, β- i γ-melanocyty oraz hormonu adrenokortykotropowego) i uwalnianie kortyzolu. Hormony te zapewniają zwiększony apetyt, wrażliwość na insulinę, metabolizm glukozy, stabilizację na bodźce anksjogenne i stresujące. Psylocyna działa jako częściowy agonista receptorów 5-НТ1А, które są głównie wyrażane w jądrze szwu (DRN) i środkowym jądrze szwu (MRN), zlokalizowanych w pobliżu linii środkowej pnia mózgu wzdłuż całego jego przedłużenia rostro-ogonowego, jako autoreceptory somatodendrytyczne. MRN promuje aktywację procesów konsolidacji pamięci i jest rzutowany do hipokampa, podczas gdy VRN jest jednym z największych jąder serotoninergicznych w ludzkim mózgu, który zapewnia znaczną ilość unerwienia serotoninergicznego przodomózgowia; ponadto MRN ma włókna projekcyjne w ciele migdałowatym i podwzgórzu, co jest związane z regulacją rytmu okołodobowego i kilku rodzajów komórek wytwarzających katecholaminę i substancję-P. DRN i MRN są bogate w presynaptyczne receptory 5-НТ1А, a psylocyna ma kilkakrotnie (5-6 razy) silniejszy efekt, szczególnie w miejscach presynaptycznych w porównaniu do postsynaptycznych. Tę preferencję tłumaczy się wysoką gęstością receptorów 5-НТ1А, które znajdują się w tych obszarach. Ten określony typ receptorów, zlokalizowany na ciałach komórek serotoninergicznych strefy raphe, nie występuje na przykład na błonach postsynaptycznych. W badaniach fMRI ujawniono, że psilocybina znacząco zmniejsza przepływ krwi i natlenienie żylne w mózgu. Fakt ten koreluje z jej subiektywnym efektem i znacząco zmniejsza pozytywne połączenie między dwoma kluczowymi węzłami strukturalnymi (mPFC и PCC). Udowodniono, że psilocybina zwiększa metabolizm glukozy w mózgu. Ponadto niektóre eksperymenty wykazały, że DMN ma również kluczowe znaczenie dla utrzymania integracji poznawczej i ograniczeń w normalnych warunkach. Po związaniu psylocyny z presynaptycznymi receptorami 5-НТ1А obszaru DRN, tłumi ona działanie tego obszaru, podczas gdy komórki leżące u jego podstaw pozostają nienaruszone i zwiększają aktywność współczulną związaną z locus coeruleus. Inne lokalizacje receptorów 5-НТ2А wykazują szybki spadek aktywności tego receptora i zmniejszenie ich gęstości po aktywacji przez psylocynę. Tak więc, psylocybina nie ma tolerancji na hamowanie działania DRN. Ważne jest, aby zauważyć, że selektywni agoniści receptorów 5-НТ1а nie są halucynogenne w swej istocie, jednak odgrywają one rolę we wpływaniu na efekty hamujące, które są identyfikowane w DRN.
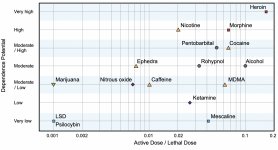
Chociaż receptor dopaminy drugiego typu odgrywa znaczącą rolę w powstawaniu halucynacji w różnych chorobach psychicznych, zakłada się, że nie ma on żadnego aktywnego i pośredniego związku z działaniem psylocyny. Hipoteza ta została po raz pierwszy udowodniona przez Vollenweidera i wsp., gdy stwierdzili oni, że podawanie galoperidolu (agonisty D2R) nie osłabia psychoaktywnych efektów psylocyny. Chociaż dopaminergiczne efekty psylocyny są uważane za minimalne, ma ona stosunkowo wysoką zdolność wiązania się z receptorem D3, w porównaniu do innych podtypów receptorów dopaminy. Pomimo faktu, że efekty, w których pośredniczy D3R zostały w niewielkim stopniu zbadane, przypuszczalnie przyczynia się on do charakterystycznych właściwości psychoaktywnych psylocybiny i jej zdolności do wywoływania uzależnienia. Chemiczny prekursor psylocyny, 4-acetoksy-N,N-dimetylotryptamina, ma grupę fosforyloksy zastąpioną grupą acetoksy. Jest ona metabolizowana w taki sam sposób jak grupa fosforyloksy, a modyfikacja ta pozwala obejść niektóre procesy metaboliczne pierwszej fazy. Pomimo tego, że psilacetyna jest identyczną substytucją farmakologiczną jak psilocybina, wielu użytkowników zgłasza, że ma pewną nieistotną, ale rozróżnialną różnicę między nimi. Psilacetyna jest często opisywana jako substancja o szybszym początku działania, która nie wiąże się z niepokojem i nudnościami (które są związane ze stosowaniem psilocybiny z powodu braku chityny, zwykle zawartej w grzybach) i ma krótszy czas działania. Powszechnie wiadomo, że mediana dawki śmiertelnej u szczurów wynosi około 293 mg/kg, co wskazuje na ogromne okno terapeutyczne psylocyny. Tachyfilaksja, szybka desensytyzacja na substancję, prowadząca do zmniejszenia efektu fizjologicznego jest zjawiskiem związanym ze stosowaniem wielu halucynogenów. Tolerancja na psilocybinę zaczyna się rozwijać już po pierwszym użyciu. Mechanizm obejmuje fizjologiczną odpowiedź na nadmierną stymulację receptorów 5-НТ2А poprzez szybką redukcję miejsc receptorowych i zmniejszenie gęstości receptorów na komórce. Ogólnie uważa się, że te miejsca receptorowe powracają do pięćdziesięciu procent pierwotnego poziomu w ciągu 3-7 dni od pierwszego użycia. Powracają one do pierwotnej ilości w ciągu 4 tygodni, w zależności od dawki i czasu trwania wielokrotnego stosowania. Poza tym istnieje tolerancja krzyżowa między klasami halucynogenów indoloalkiloaminowych i fenyloalkiloaminowych.
Attachments
-
 aDjgnEic18.jpg572.2 KB · Views: 1,667
aDjgnEic18.jpg572.2 KB · Views: 1,667 -
 sRHGpjI9LU.jpg788.9 KB · Views: 1,639
sRHGpjI9LU.jpg788.9 KB · Views: 1,639 -
 TQv018fRJh.jpg128.6 KB · Views: 968
TQv018fRJh.jpg128.6 KB · Views: 968 -
lF1rOfpW8k.jpg2.6 MB · Views: 1,003
-
 TSkYz5Gq6P.jpg363.8 KB · Views: 1,791
TSkYz5Gq6P.jpg363.8 KB · Views: 1,791 -
 sPlo2QDBMe.jpg551.6 KB · Views: 1,761
sPlo2QDBMe.jpg551.6 KB · Views: 1,761 -
 AxRV2Hfutv.jpg697.8 KB · Views: 1,782
AxRV2Hfutv.jpg697.8 KB · Views: 1,782 -
 b2Ma0wsVTD.jpg607.2 KB · Views: 1,854
b2Ma0wsVTD.jpg607.2 KB · Views: 1,854 -
 QtXjIHo7PJ.jpg438.5 KB · Views: 1,650
QtXjIHo7PJ.jpg438.5 KB · Views: 1,650 -
 rI0YMKgE6z.jpg1.1 MB · Views: 1,792
rI0YMKgE6z.jpg1.1 MB · Views: 1,792 -
 Q1ueUSGlFN.jpg614.4 KB · Views: 1,805
Q1ueUSGlFN.jpg614.4 KB · Views: 1,805
Last edited by a moderator:
